아바카비르
| |
| |
| 체계적 명칭 (IUPAC 명명법) | |
|---|---|
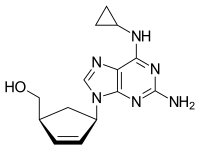
| {(1S,4R)-4-[2-amino-6-(cyclopropylamino)-9H-purin-9-yl]cyclopent-2-en-1-yl}methanol | |
| 식별 정보 | |
| CAS 등록번호 | 136470-78-5 |
| ATC 코드 | J05AF06 |
| PubChem | 441300 |
| 드러그뱅크 | DB01048 |
| ChemSpider | 390063 |
| 화학적 성질 | |
| 화학식 | C14H18N6O |
| 분자량 | 286.332 g/mol |
| SMILES | eMolecules & PubChem |
| 물리적 성질 | |
| 녹는점 | 165 °C (329 °F) |
| 약동학 정보 | |
| 생체적합성 | 83% |
| 동등생물의약품 | ? |
| 약물 대사 | Liver |
| 생물학적 반감기 | 1.54 ± 0.63 h |
| 배출 | 콩팥 (아바카비르 1.2%, 5'-카르복실산 대사체 30%, 5'-글루코나이드 대사체 36%, 기타 대사체 15%). 대변 (16%) |
| 처방 주의사항 | |
| 허가 정보 | |
| 임부투여안전성 | B3(오스트레일리아) C(미국) |
| 법적 상태 | POM (영국) ℞-only (미국) |
| 투여 방법 | 경구 투여 |
아바카비르(Abacavir)는 지아젠(Ziagen)이라는 상표명으로 판매되는 후천면역결핍증후군 예방 및 치료제다. 뉴클레오사이드 유사물 역전사 효소 억제제(NRTIs)로, 단독으로 사용되는것은 권고되지 않아 병용된다. 알약이나 물약으로 경구 복용되며, 3개월 이상의 유아에게서 안전성이 검증되었다.
심각한 부작용은 잘 나타나지 않는다. 일반적인 부작용으로는 구토, 수면장애, 발열, 피로감 등이 있다. 심각한 이상반응으로는 과민증, 간손상, 젖산산증 등이 있다.유전자 검사를 통해 환자의 과민성을 알 수 있다. 과민증의 증상으로는 발진, 구토, 호흡곤란 등이 있다.
아바카비르는 1988년 특허를 받았고, 1998년 미국에서 사용 승인을 받았다. 현재 가장 안전하고 효과적인 의약품으로 의료제도에서 필수적인 의약품 목록인 WHO 필수 의약품 목록에 등재되어 있다.제네릭 의약품이다. 2014년 기준으로 개발도상국에서 도매가는 0.36~0.83달러이다. 2016년 기준으로 미국에서 한달치 의약품을 구매하기 위해서는 70.50달러가 필요하다.라미부딘, 지도부딘, 돌루테그라비르 등과 다른 HIV 약물과 함께 판매된다. 아바카비르/라미부딘의 경우 주요 약물로 분류된다.
의학적 사용
다른 항레트로바이러스제와 조합된 아바카비르(Abacavir) 정제 및 경구 용액은 HIV-1 감염 치료에 사용된다.
아바카비르(Abacavir)는 항상 다른 항레트로바이러스 약물과 함께 사용해야 한다. 항레트로바이러스 요법이 바이러스 반응의 상실로 인해 변경되는 경우 아바카비르(Abacavir)를 단독 약제로 추가해서는 안 된다.
부작용
일반적인 부작용으로는 메스꺼움, 두통, 피로, 구토, 설사, 식욕 감퇴, 수면장애 등이 있다. 드물지만 심각한 부작용으로는 발진, AST 및 ALT 상승, 우울증, 불안, 발열 및 오한, 상기도감염, 젖산산증, 이상지질혈증, 고지혈증, 지질영양이상증 등이 있다.
간 질환이 있는 사람들은 아바카비르를 사용할 경우 병을 악화시킬 수 있기 때문에 주의해야 한다. 간 질환의 징후로는 메스꺼움과 구토, 복통, 검은 소변, 누런 피부색과 흰자위 등이 있다. 다른 뉴클레오사이드 약물과 마찬가지로 드물게 젖산산증이 나타나기도 한다. 젖산산증의 증상으로는 빠르고 불규칙한 심박, 특이한 근육통, 피로, 호흡곤란, 메스꺼움과 구토와 함께 복통이 있다. 아바카비르는 또한 면역 재구성 염증 증후군(immune reconstitution inflammatory syndrome, IRIS)을 유발할 수 있으며, 체지방의 변화뿐만 아니라 심장마비의 위험도 증가시킬 수 있다.
실험실에서 아바카비르 저항 HIV주(strain)가 개발되었는데, 라미부딘, 디다노신, 잘시타빈 등에도 저항성을 띈다. 단백질 분해효소 억제제 내성이 있는 HIV 균주는 아바카비르에 내성이 없을 가능성이 높다. 생후 3개월 미만의 유아에게 사용이 금지되며, 과다복용의 영향에 대해서는 알려진 바가 거의 없다. 약물 과다복용 환자들은 병원 응급실로 이송해 치료를 받아야 한다.
과민성증후군
과민반응은 HLA-B*5701이라는 사람백혈구항원 B 좌위의 대립유전자와 관련이 있다. 한국인에서 해당 대립유전자의 MAF(minor allele frequency)는 0.32%로, 유럽인(5%)보다 현저히 낮은 빈도로 존재한다.
아바카비르 과민증(이하 AHS)의 흔한 증상으로는 발열, 권태감, 오심, 설사가 있다. 일부 환자에서는 피부 발진으로 나타날 수 있다. AHS의 증상은 주로 투여 시작 후 6주 안에 나타나는데, 이는 HIV에 의한 증상, 면역 재구성 염증 증후군(IRIS)의 증상, 다른 약물에 의한 반응 또는 감염에 의한 증상과 혼동될 수 있다.과 혼동될 수 있다. 미국 FDA에서 2008년 7월 24일에 아바카비르 제제에 대한 안전성 서한을 고시했으며, 허가사항 상에 아바카비르 투여 전 HLA-B*5701 대립유전자를 스크리닝할 것을 권고하고 해당 대립유전자를 가진 자의 이 약의 투여를 금기하고 대체약을 투여할 것을 명시하였다. 더 나아가, CPIC (Clinical Pharmacogenetics Implementation Consortium) 및 DPWG (Dutch Pharmacogenetics Working Group) 모두에서 HLA-B*5701 대립유전자를 가진 자에게 아바카비르에 대한 대체요법을 수행할 것을 권장하였다. 대한민국 식품의약품안전처 허가사항에도 아바카비르 치료 시작 전 HLA-B*5701 대립유전자 검사를 통해 양성 여부를 확인할 것을 권고하고 있다. AHS가 의심되는 모든 환자에서 아바카비르를 즉시 영구적으로 중단해야 하며 이는 HLA-B*5701 대립유전자를 갖지 않은 자에서도 해당한다.
면역병리기전
AHS의 병리기전은 HLA-B*5701 대립유전자의 단백질 산물에 근간을 둔다. 아바카비르는 HLA-B*5701 단백질에 상당히 높은 특이성을 가지며, 결합하며 단백질의 화학적인 구조를 바꾸어 항원이 결합할 자리를 만들어낸다. 이는 아바카비르에 특이적인 세포독성 T세포를 활성화하여, 전신적인 과민반응을 유발한다.
약물상호작용
아바카비르를 포함한 뉴클레오사이드 유사물 역전사효소 억제제(NRTIs)는 간대사를 거치지 않아, CYP와 관련한 상호작용이 거의 없다. 그러나, 아바카비르의 흡수 및 생체이용률과 관련한 상호작용이 일부 있다. 아래는 아바카비르와 병용했을 때 상호작용이 발생하는 것으로 밝혀진 약물 또는 음식이다.
- 티프라나비르(tipranavir)나 리토나비르(ritonavir)와 같은 단백질분해효소 억제제(protease inhibitor)는 글루쿠론산 포합반응(glucuronidation)을 유도해 아바카비르의 혈중 농도를 감소할 수 있다. 아바카비르는 알코올 탈수소효소(alcohol dehydrogenase) 또는 글루쿠론산 포합반응을 거쳐 대사된다.
- 에탄올(ethanol)은 알코올 탈수소효소를 저해해 아바카비르의 혈중 농도를 증가할 수 있다. 아바카비르는 알코올 탈수소효소 또는 글루쿠론산 포합반응을 거쳐 대사된다.
- 메타돈(methadone)은 아바카비르의 치료 효과를 감소할 수 있다. 또한, 아바카비르는 메타돈의 혈중 농도를 감소할 수 있다.
- 오르리스타트(orlistat)은 항레트로바이러스제의 혈중 농도를 감소할 수 있다. 그 기전은 명확히 규명되지 않았으나, 오르리스타트가 아바카비르의 흡수를 감소하기 때문인 것으로 추정된다.
- 카보잔티닙(carbozantinib): 아바카비르와 같은 MRP2 차단제 (Multidrug resistance-associated protein 2 inhibitors) 계열 약물은 카보잔티닙(cabozantinib)의 혈중 농도를 감소할 수 있다.
작용기전
아바카비르는 뉴클레오사이드 역전사효소 억제제로 바이러스 복제에 관여하여 항바이러스기능을 한다. 구아노신 유사물로 인산화되어 카르보비르 3인산염(CBV-TP)이 되는데, CBV-TP는 다른 구아노신들과 바이러스 DNA에 끼워넣어진다. 일단 CBV-TP가 바이러스 DNA에 들어가게 되면 이후 전사 및 역전사효소의 활성이 억제된다.
약동학
아바카비르는 경구로 투여하며, 83%의 높은 생체이용률을 나타낸다. 아바카비르 정제와 용액은 서로 유사한 혈중 농도 프로파일과 생체이용률을 보인다. 아바카비르는 식사와 상관 없이 투여할 수 있다.
아바카비르는 혈액뇌장벽(BBB, blood-brain barrier)을 통과할 수 있다. 이는 주로 알코올 탈수소효소와 글루쿠론산 전달효소의 대사를 받으며, 각각 카복실산 대사체와 글루쿠론산 대사체로 비활성화된다. 반감기는 1.5-2.0 시간이며, 간부전 환자에서는 반감기가 58% 상승한다.
아바카비르는 소변(83%) 및 대변(16%)으로 배설된다. 아바카비르가 혈액투석 또는 복막투석으로 제거되는지는 명확하지 않다.
역사
로버트 빈스(Robert Vince)와 수잔 달루지(Susan Daluge)가 중국 과학자인 메이 화(Mei Hua)와 함께 1980년대에 이 약물을 개발하였다.
아바카비르(Abacavir)는 1998년 12월 18일 미국 식품의약국(FDA)의 승인을 받아 미국에서 승인된 15번째 항레트로바이러스제이다.
합성
참고 문헌
- Dean L (April 2018). 〈Abacavir Therapy and HLA-B*57:01 Genotype〉. Pratt VM, McLeod HL, Rubinstein WS, 외. 《Medical Genetics Summaries》. National Center for Biotechnology Information (NCBI). PMID 28520363.
외부 링크
- “Abacavir”. 《Drug Information Portal》. U.S. National Library of Medicine.
- Abacavir pathway on PharmGKB
- Abacavir dosing guidelines from the Clinical Pharmacogenetics Implementation Consortium (CPIC)
- Abacavir dosing guidelines from the Dutch Pharmacogenetics Working Group (DPWG)
| 진입/융합 억제제 |
|
||||||||
|---|---|---|---|---|---|---|---|---|---|
| 역전사효소 억제제 (RTIs) |
|
||||||||
|
통합효소 억제제 (발견과 발전) |
|||||||||
|
단백질분해효소 억제제 (발견과 발전) |
|
||||||||
| 복합제 |
|
||||||||
| Pharmacokinetic boosters | |||||||||