글리코사이드 결합
글리코사이드 결합(영어: glycosidic bond)은 화학 및 생화학에서 탄수화물(당) 분자를 다른 기(group)와 결합시키는 공유 결합의 한 유형으로, 또 다른 탄수화물이 될 수도 있고 아닐 수도 있다.
글리코사이드 결합은 탄수화물(또는 탄수화물로부터 유도된 분자)의 헤미아세탈(또는 헤미케탈)과 알코올과 같은 일부 화합물의 하이드록시기 사이에 형성된다. 글리코사이드 결합을 포함하고 있는 물질은 배당체(글리코사이드)이다.
글리코사이드라는 용어는 이제 탄수화물의 헤미아세탈(또는 헤미케탈)과 하이드록시기 이외의 여러 화학 그룹들, 예를 들면 -SR(티오글리코사이드), -SeR(셀레노글리코사이드), -NR1R2(N-글리코사이드), -CR1R2R3(C-글리코사이드) 사이에 형성된 결합을 갖는 화합물을 포함하도록 확장되었다.
특히 천연의 글리코사이드에서 탄수화물 잔기가 제거된 화합물 ROH는 아글리콘이라고 하며, 탄수화물 잔기 그 자체를 글리콘이라고 부르기도 한다.
S-, N-, C- 및 O-글리코사이드 결합
위에서 논의된 형태의 글리코사이드 결합은 글리코사이드를 아글리콘 또는 환원 말단의 당과 연결시키는 글리코사이드 결합의 산소와 관련하여 O-글리코사이드 결합으로 알려져 있다. 유사하게, 글리코사이드 결합의 산소가 황으로 치환되면, S-글리코사이드 결합(티오글리코사이드를 형성함)이라고 한다. 같은 방식으로, N-글리코사이드 결합은 글리코사이드 결합의 산소가 질소로 치환된 것이다. N-글리코사이드 결합을 포함하고 있는 물질은 글리코실아민이라고도 한다. C-글리코사이드 결합은 글리코사이드 결합의 산소가 탄소로 치환된 것이다. C-글리코사이드라는 용어는 IUPAC에 의해 잘못된 명칭으로 간주되고 있다. 이렇게 변형된 모든 글리코사이드 결합은 가수분해에 대한 감수성이 다르며, C-글리코실 구조의 경우 일반적으로 가수분해에 대한 내성이 더 강하다.
분류
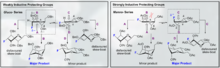
하나는 아노머 위치의 상대적인 입체화학(R 또는 S)과 탄수화물의 1번 탄소(C-1)에서 가장 멀리 떨어져 있는 입체중심을 기반으로 해서 α- 및 β-글리코사이드 결합을 구분한다. α-글리코사이드 결합은 두 탄소가 동일한 입체화학을 가지고 있을 때 형성되는 반면, β-글리코사이드 결합은 두 탄소가 서로 다른 입체화학을 가지고 있을 때 형성된다. 한 가지 복잡한 문제는 원래 α- 와 β-입체구조가 하워스 투영식에서 주요 구성 성분들의 상대적인 방향성에 근거하여 정의되었다는 것이다. D-당의 경우, β-입체구조는 고리의 평면 위에 그려진 각 탄소 주변의 주요 구성 성분을 볼 수 있지만(일반적으로 동일한 입체구조), α-입체구조는 고리 평면 아래에 그려진 아노머 탄소의 구성 성분(일반적으로 반대의 입체 구조)를 볼 수 있다. L-당의 경우에는 D-당의 경우의 반대가 된다. 이러한 오래된 정의는 여전히 과학 문헌에 남아 혼란을 초래할 수 있기 때문에 주목할 가치가 있다.
약리학자들은 물질의 수용성을 높이기 위해 글리코사이드 결합을 통해 글루쿠론산을 물질에 첨가한다. 이것은 글루쿠론산화로 알려져 있다. 다른 많은 배당체들은 중요한 생리 기능을 가지고 있다.
글리코사이드 가수분해효소
글리코사이드 가수분해효소(글리코시데이스)는 글리코사이드 결합을 분해하는 효소이다. 글리코사이드 가수분해효소는 전형적으로 α-글리코사이드 결합 또는 β-글리코사이드 결합에 작용할 수 있지만, 둘 다에서 작용하지는 않는다. 이러한 특이성으로 인해 연구자들은 높은 에피머 초과량의 글리코사이드를 얻을 수 있는데, 한 예로 글루코사이드 가수분해효소를 이용해서 D-글루코스를 에틸 β-D-글루코피라노사이드로 전환한 것이 있다. 글루코사이드 가수분해효소를 효소의 생물학적 기능과는 정반대로 사용했다는 점은 주목할 필요가 있다.
글리코실트랜스퍼레이스
단당류 단위체가 살아있는 생물체의 당단백질, 다당류 또는 지질에 통합되기 전에 이들은 일반적으로 유리딘 이인산(UDP), 구아노신 이인산(GDP), 디옥시티미딘 이인산(dTDP), 사이티딘 일인산(CMP)과 같은 뉴클레오타이드의 인산기에 글리코사이드 결합을 통해 결합함으로써 먼저 "활성화"된다. 이렇게 활성화된 생화학 중간생성물들은 당뉴클레오타이드 또는 당 공여체로 알려져 있다. 많은 생합성 경로들은 돌리콜과 같은 지질에 이인산 결합으로 활성화된 단당류 또는 올리고당류를 사용한다. 이들 활성화된 공여체는 글리코실트랜스퍼레이스로 알려진 효소에 대한 기질이며, 글리코실트랜스퍼레이스는 활성화된 공여체로부터 수용체 기질(친핵체)로 당 단위체를 전달한다.
이당류 포스포릴레이스
지난 수십 년 동안 배당체 합성을 위해 서로 다른 생물 촉매 접근법이 개발되었는데, 이러한 접근법은 글리코실트랜스퍼레이스와 글리코사이드 가수분해효소를 사용하는 것이 가장 일반적이다. 글리코실트랜스퍼레이스는 종종 값비싼 재료를 필요로 하며, 글리코시데이스는 종종 낮은 수율을 보인다. 드 윈터(De Winter) 등은 이온성 액체에서 알파-글리코사이드 합성을 위한 셀로비오스 포스포릴레이스의 사용을 조사했다. 셀로비오스 포스포릴레이스의 사용을 위한 최상의 조건은 IL AMMOENG 101과 아세트산 에틸이 존재하는 조건으로 밝혀졌다.
글리코실화
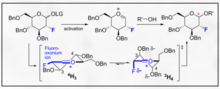
α- 및 β-글리코사이드 결합의 선택성을 촉진하기 위한 여러 가지 화학적 접근법이 존재한다. 피라노사이드의 선택성 및 전체적인 활성에 대한 높은 기질 특이성은 주요 합성에 어려움을 줄 수 있다. 글리코실화의 전체적인 특이성은 전형적인 글리코실화 동안 아노머 탄소가 겪을 수 있는 상대적인 전이 상태를 고려한 접근법을 이용함으로써 개선될 수 있다. 가장 주목할만한 것은 전이 상태에서 이러한 유형의 입체구조적인 조절을 수행할 수 있다면, 펠킨-안 에이젠슈타인(Felkin-Ahn-Eisenstein) 모델을 이론적 화학 설계로 인정하고 통합하는 것은 일반적으로 신뢰할 수 있는 결과를 제공할 수 있다는 것이다.
약학적 사용
O-결합 글리코펩타이드
O-결합 글리코펩타이드는 질병을 가진 여러 모델 동물에서 우수한 CNS 투과성 및 효능을 보이는 것으로 나타났다. 또한 가장 흥미로운 측면 중 하나는 O-글리코실화가 반감기를 늘리고, 클리어런스를 감소시켜며, CNS 침투를 증가시켜 활성 펩타이드의 PK/PD를 개선시키는 능력이다. 2단계와 3단계 대사(글루쿠론산)에서 가용화 부분으로서 당의 활용은 포유류 효소가 보다 큰 부분의 O-글리코실화된 생성물을 분해하도록 직접적으로 진화하지 않았다는 점에서 진화상의 이점을 현저하게 허용하였다.
O-결합 글리코펩타이드의 특성은 CNS 침투제로서 많은 예들이 있다. 이러한 효과의 근본적인 근거는 "멤브레인 호핑(membrane hopping)" 또는 "홉 확산(hop diffusion)"을 포함하는 것으로 생각된다. 비브라운 운동에 의한 홉 확산 과정은 원형질막의 불연속성으로 인해 일어난다고 생각된다. 홉 확산은 특히 자유 확산과 상호비교적 전환이 결합되어 있다. 최근의 예들은 다른 펩타이드들 중에서도 특히 메트엔케팔린(metenkephalin) 유사체의 높은 투과성을 포함한다. 또한 뮤-오피오이드 수용체(μ-opioid receptor)의 작용제인 DAMGO는 펜타펩타이드로 글리코실화되면 CNS 침투제가 된다.
같이 보기
- Marco Brito-Arias, "Synthesis and Characterization of Glycosides", second edition, Editorial Springer 2016.
외부 링크
- Definition of glycosides, from the IUPAC Compendium of Chemical Terminology, the "Gold Book"
- Varki A et al. Essentials of Glycobiology. Cold Spring Harbor Laboratory Press; 1999. Searchable online